| その1:線虫類 | :蛔虫,アニサキス,蟯虫,鞭虫,鉤虫類,犬糸状虫 |
| その2:条虫類 | :広節裂頭条虫,無鉤条虫,瓜実条虫,マンソン裂頭条虫,小形条虫,縮小条虫,多包条虫 |
| その3:吸虫類 | :横川吸虫,肝吸虫,ウエステルマン肺吸虫,マンソン住血吸虫,日本住血吸虫,ビルハルツ住血吸虫 |
| その4:原虫類1 | :マラリア,赤痢アメーバ,大腸アメーバ |
| その5:原虫類2 | :トキソプラズマ,ランブル鞭毛虫,トリパノソーマ,腟トリコモナス |
| その6:衛生動物 | :※外来講師による実習 |
| その7:糞便検査 | :直接薄層塗抹法,セロハン高層塗抹法,硫苦・食塩水浮遊法,MGL法 |
|
線虫類 |
|
| 行動目標: |
|
| 1)蛔虫 Ascaris lumbricoides | |
|
①成虫の肉眼的観察 |
|
| 使用材料: |
各班一匹ずつの雌雄の成虫
|
| 観察のポイント: |
学ぶ点は,蛔虫の大きさ,形,色を記憶することにある。最初に雌雄の区別を行う。虫体の先端〔口唇のある側〕と後端は分かるか?虫体を手に取って口唇(接眼レンズを反対にして覗く),交接輪,交接刺,などを確認せよ。蛔虫に触れた経験を積むだけで充分である。スケッチは不要。来年も使うので時々水に浸けて乾燥させないように!
|
|
②虫卵の観察(100-400倍) ※蠕虫類の虫卵観察は100倍を基本とする。実習を通じては100倍で見た虫卵の見え具合を学ぶこと。 |
|
| 使用材料: |
小試中の虫卵懸濁液(受精卵と不受精卵を含む)。
|
| 手技: |
スライドグラス上に1滴とってカバーグラスを載せて観察(*5分を越えて観察する場合は周囲に水を一滴加える。そうしないと乾燥して虫卵が破壊される。このことは今後の全ての蠕虫卵の観察に適用される)。
|
| 観察のポイント: |
まず受精卵と不受精卵の区別をすること。タンパク膜,卵内容,卵殻の形状それぞれを正確に観察・スケッチせよ(受精卵,不受精卵ともにスケッチすること)。
|
| 2)アニサキス Anisakis sp. | |
|
①サバの解剖(各班2匹) |
|
| 使用材料: |
30cm以上の冷凍してないサバ,近畿の各地から購入してきたもの。
|
| 手技: |
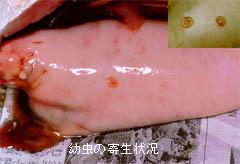
サバの内臓から幼虫を回収する(写真参照)。内臓表面を注意深く観察すると被嚢した幼虫が見つかるのでまず備え付けのピンセットで生理的食塩水に回収する。次いでこれらを酢,醤油,水の中に入れ1時間後の生存の有無を調べる。
|
| 観察のポイント: |
回収したアニサキス幼虫はその大きさ・形をしっかり把握すること。魚の内臓に被嚢している様子,さらには生理的食塩水中での動きも観察せよ。酢や醤油で幼虫を殺すことが出来るのか?
|
|
②アニサキス断端の病理標本 |
|
| 使用材料: |
アニサキス断端のHE染色標本(標本Nos. 37-40)(100-400倍)
|
| 観察のポイント: |
典型的な下の写真(宇賀の自慢の標本)をみてまず感心せよ。今日見る標本はこれほど立派ではないが,消化管の形態,筋細胞,角皮下層,角皮(クチクラ),それとアニサキスに特有の2個の双葉状の側索細胞(時には一個しか見えない時がある)が見えるはずである。スケッチは不要。

|
| 3)蟯虫 Enterobius vermicularis | |
|
①スコッチテープの観察(100-400倍) |
|
| 使用材料: |
スコッチテープで回収された虫卵。
|
| 手技: |
テープを2枚のスライドグラスではさんで観察せよ。
|
| 観察のポイント: |
虫卵の形を把握することが重要。色,卵内容はどうか?何が見えて何が見えないのか?スケッチは不要。

|
| 4)鞭虫 Trichuris trichiura | |
|
①虫卵の観察(100-400倍) |
|
| 使用材料: |
小試中の虫卵懸濁液
|
| 手技: |
スライドグラス上に1滴とってカバーグラスを載せて観察せよ。
|
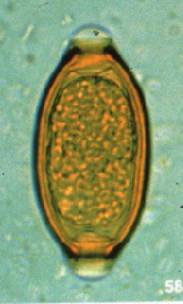
| 観察のポイント: |
典型的な鞭虫卵を見ることができるはずである。見つかったらそれが正しいかを教官に尋ねて確認した後、スケッチせよ。鞭虫卵の特異的な形態を記憶しておくこと。栓の様子,色,卵内容はどうか?写真参照。
|
|
②成虫の肉眼的観察 デモ標本として展示してある。先端と尾端部および雌雄の区別が重要である。 |
|
| 5)鉤虫類 Ancylostoma sp. | |
|
①虫卵の観察(100-400倍) |
|
| 使用材料: |
小試中の虫卵懸濁液
|
| 手技: |
スライドグラス上に1滴とってカバーグラスを載せて観察せよ。
|
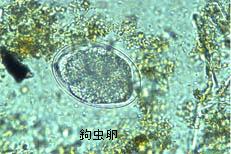
| 観察のポイント: |
虫卵の形を把握することが重要。色,卵殻の厚さ、卵内容はどうか?スケッチが必要。写真参照。
|
|
②成虫の肉眼的観察 |
|
| 使用材料: |
各班1-2匹の成虫。
|
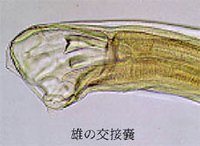
| 観察のポイント: |
成虫の形態を肉眼で観察せよ。雌雄の区別は可能か?スケッチは不要。

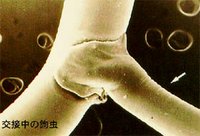
|
| 6)犬糸状虫 Dirofilaria immitis | |
|
①イヌの心臓に寄生の成虫 デモ(見るだけでいい)。 |
|
| △「寄生虫学実習」のトップへ | |
|
条虫類 |
|
| 行動目標: |
|
| 1)広節裂頭条虫 Diphyllobothrium latum | |
|
①体節のホルマリン漬標本(肉眼-接眼レンズ) |
|
| 観察のポイント: |
擬葉目,円葉目を意識しつつ,体節の形,子宮孔,生殖門の位置を確認せよ。スケッチは不要。無鉤条虫の体節と同じシャーレに入っている。


|
| 2)無鉤条虫 Taeniarhynchus saginatus | |
|
体節の観察項目は広節裂頭条虫と同じ。両者の違いを比較しつつ観察すること。スケッチは不要。広節裂頭条虫と同じシャーレに入っている。
|
|
| 3)瓜実条虫 Dipylidium caninum | |
|
①頭節の観察(接眼レンズ-100倍) |
|
| 使用材料: |
瓜実条虫の頭節(各班2-3個)。マンソン裂頭条虫の頭節と同じシャーレに入っている。
|
| 観察のポイント: |
円葉目の頭節はどうなっているかを瓜実条虫を用いて観察・スケッチせよ。吸盤は見えるか?何個あるか?別名犬条虫とも呼ばれる。スライドグラス上で水に浮かべて観察せよ。

|
| 4)マンソン裂頭条虫 Spirometra erinacei | |
|
①頭節の観察(接眼レンズ-100倍) |
|
| 使用材料: |
マンソン裂頭条虫の頭節(各班2-3個)。瓜実条虫の頭節と同じシャーレに入っている。
|
| 観察のポイント: |
擬葉目の頭節はどうなっているのかをマンソン裂頭条虫を用いて観察せよ。スケッチは不要。吸溝は何対あるのか?
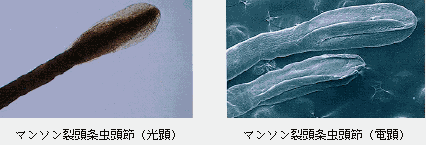
|
| 5)小形条虫 Vampirolepis nana | |
|
①虫卵の観察(100-400倍) |
|
| 使用材料: |
小試に入った懸濁液(縮小条虫卵も入っている)。
|
| 観察のポイント: |
虫卵の内部の六鉤幼虫(特に鉤の形状)を観察・スケッチせよ。幼虫被殻の形状はどうか?フィラメントは見えるか?
|
| 6)縮小条虫 Hymenolepis nana | |
|
①虫卵の観察(100-400倍) |
|
| 使用材料: |
小試に入った懸濁液(小形条虫卵も入っている)。
|
| 観察のポイント: |
虫卵の内部の六鉤幼虫を観察せよ。小形条虫と比較しつつスケッチすることが重要である。
|
| 7)多包条虫 Echinococcus multilocularis | |
|
①虫体の観察(接眼レンズ-100倍) |
|
| 使用材料: |
多包条虫の成虫(ホルマリン固定してある)。
|
| 観察のポイント: |
全長1.7-3.7mm。先端から頭節,未熟体節,成熟体節,受胎体節と体節は3つしかない。かわいいけど怖い虫である。スケッチせよ。

|
| △「寄生虫学実習」のトップへ | |
|
吸虫類 |
|
| 行動目標: |
|
| 1)横川吸虫 Metagonimus yokogawai | |
|
①成虫の染色標本(100倍) |
|
| 使用材料: |
カルミン染色標本(標本Nos. 55-56)。高橋吸虫となっているものも横川吸虫として取り扱う(両種を比較して違いが分かった人はエライ)。
|
| 観察のポイント: |
成虫の大きさ,形を肉眼で把握する。その後顕微鏡下で成虫体の各部(口吸盤,生殖腹吸盤装置,精巣,卵巣,子宮,子宮内虫卵等)をスケッチ(この虫か肝吸虫のどちらか一方でよい)せよ。
|
|
②小試に入った虫卵(100-400倍)(右; 横川吸虫卵,左; 肝吸虫卵) |
|
| 観察のポイント: |
小試には肝吸虫卵と一緒に懸濁してある。両者の区別を意識しつつ同じ倍率でその違いを明確にスケッチせよ(写真参照)。
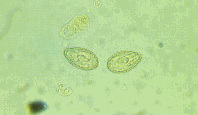
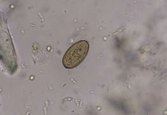
|
|
③淡水魚に寄生したメタセルカリア(接眼レンズ-40倍) |
|
| 使用材料: |
兵庫県千種川産の淡水魚(カワムツ)各班一匹。食べたら感染。
|
| 手技: |
体表を肉眼あるいは接眼レンズを用いて観察する。メタセルカリアの付着の様子が分かるか?次いでピンセットを用いて鱗を剥がし,スライドグラス上に回収する。これらは2,3滴の水で懸濁,針やピンセットで良くほぐした後カバーグラスをかけて顕微鏡(40倍-100倍)で観察する。スケッチは不要である。以下に示した図(aは肝吸虫のメタセルカリアを、そしてbは横川吸虫のメタセルカリアを示す)を参照せよ。
|
| 観察のポイント: |
被嚢幼虫の様子を観察する。幼虫の動きはあるか?口吸盤,排泄嚢などは見えるか?
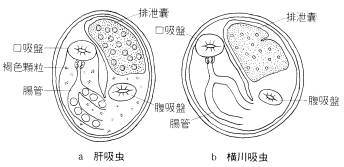
|
| 2)肝吸虫 Clonorchis sinensis | |
|
①成虫の染色標本(40-100倍) |
|
| 使用材料: |
カルミン染色標本(標本No. 57)。
|
| 観察のポイント: |
成虫の大きさ,形を肉眼で把握する。その後顕微鏡下で成虫体の各部(口吸盤,腹吸盤,精巣,卵巣,子宮,子宮内虫卵等)をスケッチ(この虫か横川吸虫のどちらか一方でよい)せよ。
|
|
①小試に入った虫卵(100-400倍) |
|
| 観察のポイント: |
小試には横川吸虫卵と一緒に懸濁してある。両者の区別を意識しつつ同じ倍率でその違いを明確にスケッチせよ(写真参照)。
|
| 3)ウエステルマン肺吸虫 Paragonimus westermani | |
|
①成虫の染色標本(肉眼-100倍) |
|
| 使用材料: |
成虫標本(Nos. 58-59)。
|
| 観察のポイント: |
成虫の大きさ,形を肉眼で把握する。その後顕微鏡下で成虫体の各部(口吸盤,腹吸盤,精巣,卵巣,子宮,子宮内虫卵等)を観察せよ。スケッチは不要。(写真参照)。
|
|
①小試に入った虫卵(100-400倍) |
|
| 観察のポイント: |
虫卵の形態的特徴はすでに詳細に講義してある。その点を注意しつつスケッチせよ。特に虫卵と卵蓋の大きさ(その比率)に注意すること(写真参照)。
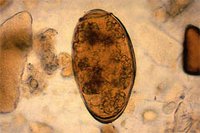
|
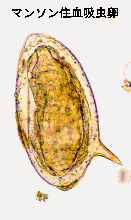
| 4)住血吸虫類の虫卵 | |
|
①虫卵の観察(100-400倍) |
|
| 使用材料: |
小試に入った懸濁液(マンソン住血吸虫,Schistosoma mansoni;日本住血吸虫,Schistosoma japonicum;ビルハルツ住血吸虫,Schistosoma haematobiumの虫卵を含む。)
|
| 観察のポイント: |
添付した写真を参考にしながら虫卵の形態的特徴を観察する。卵蓋はあるか?卵内容や色は?スケッチは3種のうちどれか1種でよい。
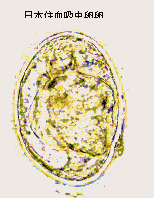

|
| 5)デモ標本 | |
|
教卓に次の標本類を置いておく。今日の実習とどう関わっているかを理解した上で見ておくこと。アユ,モクズガニ,カワニナ、ホラアナミジンニナなど。
|
|
| △「寄生虫学実習」のトップへ | |
|
原虫類1 |
|
| 行動目標: |
|
| 1)マラリア原虫 Plasmodium falciparum, P. vivax | |
|
①血液塗抹標本作製(マウスを使って全員が行う) |
|
| 使用材料: |
ICR系のアルビノマウス(何も感染しないが,ネズミは噛む)
|
| 手技: |
尾の先端の1-2mmをハサミで切る・尾をしごいて,血液をスライドグラス上に載せる・後にイラストで示した要領で薄層塗抹標本を作製(教官に見せて出来映えを確認する) 続いて同じスライドグラス上に厚層塗抹標本を作製(その位置に注意) 十分に乾燥後溶血・無水アルコールにて固定(2・3分)・ギムザ染色(30分)・水洗・乾燥・観察(油浸を使う)。 |
| 操作のポイント: |
本実習では上記の塗抹標本作製・ギムザ染色手技のうち,アンダーラインの部分のみを行う。操作のポイントは①薄層塗抹はまっすぐ一定のスピードで行う,②薄層塗抹の観察場所を意識する,事が重要である。
|
|
②マラリア原虫のギムザ染色標本の観察(全員が行う:1,000倍) |
|
| 使用材料: |
標本箱の中の熱帯熱マラリア原虫(P. falciparum)(Nos. 1~3)と三日熱マラリア原虫(P. vivax)(Nos. 4~6)。
|
| 手技: |
各原虫の赤内型の特徴を1,000倍(油浸)にてスケッチせよ。
|
| 観察のポイント: |
①熱帯熱マラリア原虫では輪状体/アメーバ体の時期の虫体(モーラー斑点に注意)と生殖母体を,②三日熱マラリア原虫では輪状体/アメーバ体の時期の虫体(被寄生赤血球の膨化およびシュフナー斑点に注意)を観察・スケッチせよ(準備した標本で全てが見えるとは限らないので,その場合は省いても良い)。
|
| 2)赤痢アメーバ Entamoeba histolytica | |
|
①栄養型虫体の観察(全員が行う:100-400倍) |
|
| 使用材料: |
小試に入れた培養虫体(感染性は無いが取り扱い注意)
|
| 手技: |
小試に懸濁してある栄養型虫体をパスツールピペットを用いてスライドグラス上に一滴とってカバーグラスをかけてその動きを観察せよ。
|
| 観察のポイント: |
じっと見続けると動きがわかる。まず赤痢アメーバの動きを理解すること。外肉,内肉が区別できるか? 内肉に何か見えるか?スケッチは不要。
|
|
②栄養型のヨード・ヨードカリ染色(全員が行う:400倍) |
|
| 使用材料: |
小試に入れた培養虫体(感染性は無いが取り扱い注意)
|
| 手技: |
パスツールピペットを用いてスライドグラス上に虫体懸濁液を一滴落とす。次いでヨード・ヨードカリ液(小試)を別のパスツールピペットで虫体液の隣りに一滴(同量)とり,これをカバーグラスの角で撹拌混合する。虫体は直ちに固定染色されるので,カバーグラスを載せて観察せよ。 (添付のイラストを参考にせよ) |
| 観察のポイント: |
虫体の状況によっては核や核小体が観察される。典型的な形を選んで,その様子をスケッチせよ。
|
|
③シストのコーン染色標本(400-1000倍) |
|
| 使用材料: |
標本箱No. 9
|
| 観察のポイント: |
核と核小体の様子が明確に観察できる。お薦め標本だけどスケッチは不要。余裕があれば観察しておく。
|
| 3)大腸アメーバ Entamoeba coli | |
|
①シストのヨード・ヨードカリ染色(全員が行う:400倍) |
|
| 使用材料: |
小試に入れた懸濁液(ホルマリン固定済み)
|
| 手技: |
赤痢アメーバの栄養型の染色法に準ずる。
|
| 観察のポイント: |
観察は常に赤痢アメーバのシストと比較しながら行うこと。核数は?、核内における核小体の位置は?、全てのシストでこれらが見られるわけではない。いくつかを探して典型的な形の見られるものを選んで観察・スケッチせよ。
|
| △「寄生虫学実習」のトップへ | |
|
原虫類2 |
|
| 行動目標: |
|
| 1)トキソプラズマ Toxoplasma gondii | |
|
①急増虫体の染色標本の観察(400-1,000倍) |
|
| 使用材料: |
急増虫体のギムザ染色標本(標本Nos. 15-17)
|
| 観察のポイント: |
虫体の鋭端と鈍端が確認できるか?核はどちら側にあり,何色に染まっているのかを観察せよ。スケッチをする必要はない。
|
|
②シストの観察(マウス脳に寄生する生の標本) (100-400倍) |
|
| 使用材料: |
トキソプラズマ感染マウス脳(感染性あり取り扱い注意)の圧平標本
|
| 手技: |
実習中に教官が標本を作製,各班(各班3枚程)に配布する。スケッチの後は必ず各自で教卓に返すこと。
|
| 観察のポイント: |
大きさ? 形? 内部の虫体の形などを意識してスケッチせよ。 |
|
③オーシストの観察(400-1,000倍) |
|
| 使用材料: |
小試に入ったホルマリン懸濁液。
|
| 観察のポイント: |
スポロシストやスポロゾイトなどが見えるか?それらを意識して観察せよ。スケッチは不要。
|
| 2)腟トリコモナス Trichomonas vaginalis | |
|
①栄養型虫体の観察(400倍) |
|
| 使用材料: |
小試に入れた培養虫体
|
| 手技: |
小試に懸濁してある栄養型虫体をスライドグラス上に一滴とってカバーグラスをかけて観察・スケッチせよ。ビチビチ動いて見にくいときは,下からライターで加熱して半殺しにしてから観察すると見やすい(特に鞭毛の動きなど)。
|
| 観察のポイント: |
100倍で虫体を見つけて,400倍でスケッチせよ。鞭毛の動きは?波動膜の様子は?
|
| 3)ランブル鞭毛虫 Giardia intestinalis | |
|
①栄養型の染色標本の観察(400-1,000倍) |
|
| 使用材料: |
ギムザ染色標本(標本Nos. 27-29、写真)
|
| 観察のポイント: |
特徴的な形をスケッチせよ(サルの顔のような形をしているか?)。鞭毛数,核数が確認できるか?
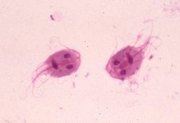 ランブル鞭毛虫の栄養型 |
|
②シストの観察(400-1,000倍) |
|
| 使用材料: |
ハイデンハイムの鉄ヘマトキシリン染色(標本No. 30)
|
| 観察のポイント: |
全体の大きさ・形(重要),核数,折りたたまれた鞭毛は見えるか?相当きれいな標本だが,スケッチは不要。
|
|
③シストの観察(400倍) |
|
| 使用材料: |
小試に入ったランブル鞭毛虫のシストのホルマリン懸濁液
|
| 手技: |
懸濁液を一滴とってカバーガラスをかける。
|
| 観察のポイント: |
全体の大きさ・形(重要),核数,折りたたまれた鞭毛などをスケッチせよ。糞便検査で見かける可能性がある。しっかり実習すること。
|
| 4)トリパノソーマ Trypanosoma sp. | |
|
①錐鞭毛期(血液寄生時の形)の生きた虫体の観察(100-400倍) |
|
| 使用材料: |
感染マウスの血液
|
| 手技: |
マウスの尻尾の先端より血液を一滴スライドグラス上にとり,カバーグラスをかけて観察せよ(絞りを絞れば見やすい)。動いている姿を見て喜べばいい。スケッチは必要としない。
|
| 観察のポイント: |
虫体の動き,大きさ,形を観察せよ。
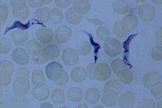 トリパノソーマ(錐鞭毛期) |
| △「寄生虫学実習」のトップへ | |
|
衛生動物 |
|
|
外来講師による衛生動物の実習を行う。実習書は割愛する。
|
|
| △「寄生虫学実習」のトップへ | |
|
糞便検査 |
|
| 行動目標: |
|
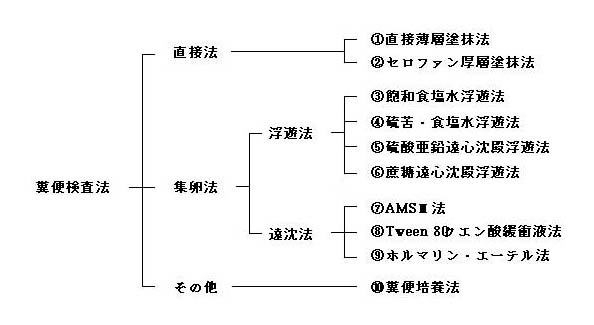
|
|
|
①直接薄層塗抹法(全員が行う) |
|
| 手技: |
スライドグラス上に生理食塩水(または水)を1滴落とす。楊枝で糞便塊の各所からマッチ棒の頭よりやや少なめの糞便(約3mg)をとり,これをよく混和して薄め,その上にカバーグラス(18×18mm)を載せる。
|
| 注意: |
1)標本の濃度は下に敷いた新聞紙の活字がかろうじて読める程度を目安とし,糞便の黄褐色が灰色に変わる色が適当である。 2)標本は乾きやすいので,水2にグリセリン1の割合に混ぜたものを生理食塩水の代りに用いてもよい。 |
|
②セロファン厚層塗抹法(全員が行う) ※カバーグラスの代りにセロファンを使用する方法である。直接薄層塗抹法に比べて,一度に大量の糞便を用いるので寄生虫卵の検出力が優れている。特に集団検査には標本の作りやすさ,経費の点から好適とされる。しかし,検鏡時に寄生虫卵の形態的特徴が不明瞭になったり,虫卵によっては変形するため,鑑別には熟練を要する。 |
|
| 準備: |
1)セロファンの規格…やや厚めのものでセロファン規格300番(20μm)あるいは350番(23μm)を26×28mm大に切っておく。 2)セロファン浸漬液…蒸留水(または6%石炭酸液) 500ml,グリセリン 500ml,3%マラカイトグリーン液 5ml 3)セロファン紙を上記浸漬液中にセロファンが相互にくっつかないように1枚づつ投入し,一昼夜以上浸漬しておく。 |
| 手技: |
1)糞便約60~70mg(小豆の大きさより一まわり小さい程度の量)をスライドグラス上にとる。 2)浸漬液からセロファンを出し,軽くふって余分な液をふり落としてから糞便の上にかぶせる。 3)ゴム栓で上から強く圧して便をスライドグラス上に伸展させて検鏡する。この時充分に糞便を圧平し下の活字が見える程度にまで伸展させておかないと,虫卵が観察できないので注意を要する。 |
| 注意: |
1)検鏡の時期は標本作成直後よりやや乾燥した方が寄生虫卵の識別度は高いので,約20~40分間そのまま室内に放置してから検鏡する(この間にグリセリンが浸透し,糞便の透化がおこる)。 2)本法はカバーグラスによる直接塗抹法の標本と虫卵の見え方が異なる場合がある。比較的卵殻の厚い蛔虫卵や鞭虫卵では差はないが,卵殻の薄い鉤虫卵や東洋毛様線虫卵では標本の乾燥がすすむにつれて虫卵が変形し,かなり大きく丸味をおびてくる。 |
|
③飽和食塩水浮遊法(実習は行わない) |
|
| 準備: |
飽和食塩水(比重1.200)は,水に充分量の食塩(40g以上)を加えて加熱,振とうして作る。通常,容器に食塩の結晶が溶けないで残る程度の食塩を加えると飽和食塩水ができるので,この上ずみを用いる。
|
| 手技: |
④の硫苦・食塩水浮遊法の項に示した。
|
|
④硫苦・食塩水浮遊法(各班2本行う) 飽和食塩水浮遊法では浮遊作業中に試験管口に食塩結晶の折出を生じ観察が困難となる。そこでこの欠点を補うために,硫酸マグネシウム(硫苦)を追加し高比重液(比重1.230)を作製したのが本法である。 |
|
| 準備: |
1)硫苦・食塩水液…温水 1,000ml,食塩(局方) 290g,硫酸マグネシウム 185g
|
| 手技: |
1)小試験管に糞便を0.5g入れ,浮遊液を5-6 ml加えて箸などで充分に撹拌(1分程度)する。 2)小試験管を試験管立に立て,液の表面が試験管の口に凸面を作るまで浮遊液を加え,30~45分間放置する。 3)脱脂したカバーグラスを液面に近づけて盛り上った液層の頂点に静かに接して液を付着させ,これをスライドグラス上にのせて検鏡する。 |
| 注意: |
1)糞便の撹拌が不充分であると,粗大残渣の下に虫卵が入ったり,虫卵が糞便から離れないため浮上しない(重要!注意すること)。 2)検査時間が30分以内では虫卵は浮上しない。また,1時間以上放置すると浮上した虫卵は対流その他によって沈降する可能性がある。 3)鉤虫卵や東洋毛様線虫卵のような比重の小さい虫卵の分離には最適であるが,比重の大きい吸虫卵や回虫の不受精卵などの検出には不適当である。 |
|
⑤硫酸亜鉛違心沈殿浮遊法(実習は行わない) 虫卵のほかに糞線虫の幼虫なども検出できるほか,原虫類の嚢子も破壊されずに検出される。本法に使用する液は比重1.18であるので比重がそれより重い多くの吸虫卵,条虫卵の検査に不適当である。 |
|
|
⑥蔗糖遠心沈殿浮遊法(実習は行わない) 比重1.200の蔗糖液を用いる。クリプトスポリジウムやサイクロスポーラなどの原虫の検査には特に有効であるし蔗糖の結晶が出来にくく1-2日は標本を保存できるなどの長所を有する。しかし,比重の重い吸虫類などの虫卵の検査には適さないため,検査対象が限定される欠点を有する。 |
|
| 準備: |
1)蔗糖浮遊液…温水 650ml,蔗糖(局方) 500g,石炭酸 6.5ml *蔗糖は溶けにくいので,スターラーなどを用いて攪拌しながら溶かす。石炭酸を加えておけば,室温で長期間(一年以上)保存できる。 |
| 手技: |
1)小試験管に糞便を0.5g入れ,浮遊液を5-6ml加えて箸などで充分に攪拌。 2)液を8分目程度まで加えた後,2,000回転,10分間の遠心分離を行う。 3)遠心後の液面から白金耳を用いて数滴分の液をスライドグラス上に回収。 |
| 注意: |
1)糞便の攪拌が不十分であると,粗大残渣の下に虫卵が入ったり,虫卵等が糞便から離れないため浮上しない(重要!注意すること)。 2)クリプトスポリジウムのオーシストの検出を試みる場合は位相差装置を用い,対物レンズは400倍で観察することを勧める。サイクロスポーラの場合は蛍光顕微鏡下で自家蛍光を確認すること。 |
|
⑦AMSⅢ法(実習は行わない) 住血吸虫卵の検査のために開発された方法であるがその他の吸虫卵の検出にもよい。 |
|
|
⑧Tween80クエン酸緩衝液法(大島法)(実習は行わない) 小形の虫卵を対象に開発された検査法であるが,大形吸虫卵をはじめ,線虫卵,条虫卵の検出にもむき,虫卵回収率も優れている。沈渣の少ないのも本法の利点である。 |
|
|
⑨ホルマリン・エーテル法(MGL法)(各班2本行う) 界面活性剤を用いない遠心沈殿法の中で最良のものである。各種虫卵のほか原虫嚢子も検出できることに加えて,10倍希釈のホルマリン使用により,沈渣が保存できる長所もある。 |
|
| 手技: |
1)糞便約0.5gをプラスチック製の小試験管にとり,5-6mlの10倍希釈ホルマリンを加えて充分混和する。 2)さらにホルマリンを追加,全体で7-8 mlとなるようにする。その状態で室温に30分間静置する。 3)ガーゼ(実習では茶こしを用いる)でガラス製の小試験管に濾過した後(全体の液量が7-8 mlとなるよう必要に応じて液を追加する),エーテルを2-3cmの高さに重層し,親指で密栓(ビニールテープで被った上を押さえると指が汚れない)をして20-30秒間はげしく振る(指を放すときは内圧が高まっているために注意しないと内容物が飛び出す。嫌いな人の方に向けて指を放すのも・・・?)。 4)直ちに2,000回転で1分間遠心し,管壁に付着した浮上糞便層部分(上の図aの上から2番目の矢印)を剥がした(爪楊枝で管壁の内面をこする)後に上ずみを捨てる。 5)管壁の内面に糞便が残っている場合は綿棒で拭う(b)。 6)沈渣(c)をピペットでとり観察(d)する。 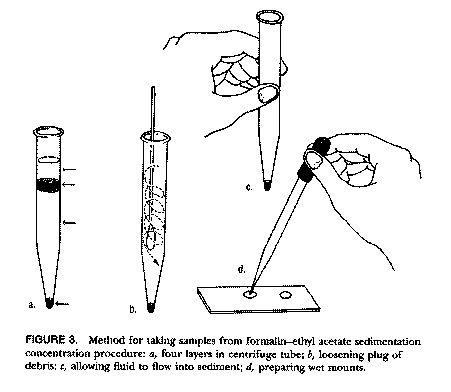
|
|
⑩糞便培養法(デモ) |
|
| 手技: |
1)濾紙を長さl5cm,巾1cm(巾2cmにして長い方向に中央に折り目をつけてもよい)の短冊形に切る。 2)上下両端各4cmを除いた片面に糞便を塗る。 3)厚く塗ると虫卵の孵化率は悪くなる。糞便の量は0.5gとして均等に薄く塗る。 4)この濾紙を,あらかじめ4-5mlの水を入れた中試験管内に入れ,濾紙の下端を水中に浸たす。この時,細菌に汚染されて水が腐らないように塗布部分が水中に入らないようにする。 5)濾紙の上端は試験管口から1cm位出してゴム栓をするか,またはポリエチレン紙で蓋をする。 6)25℃-30℃の孵卵器でl0-l4日放置すると,フィラリア型幼虫が管底の水の部分に集まるので濾紙を抜きとって捨て,管底の水とともに幼虫をピペットで吸いあげてスライドグラス上にとって観察する。 |
| 実習レポートの作成: |
1)検査を通じて回収された虫卵やシスト等を同定しスケッチせよ(同じものを重複してスケッチする必要はない)。 2)どの方法でどんな虫卵が回収できたかを比較すると共に,それぞれの方法の長所や短所等気付いた点を示せ。 |
| △「寄生虫学実習」のトップへ | |